|
(Corrigé en-dessous de l'énoncé)
|
3éme
- CONTRÔLE DE CHIMIE - 1h00
Calculatrices autorisées
|
12
octobre 2004
1ère partie : restitution du cours
Exercice 1
Que savez-vous sur les atomes, leurs tailles, leur
composition ?
Exercice 2
Que savez-vous sur les molécules ?
Exercice 3
Que savez-vous sur les ions ?
2ème partie : application directe du
cours
Exercice 4
Soit l’atome d’aluminium (Al ; Z=13).
1) Que
représente Z ?
2)
Quels sont les constituants de l’atome d'aluminium; quelles
sont leurs charges électriques ?
3) Dessinez
le modèle planétaire de l’atome d'aluminium.
4) L’ion
aluminium a pour symbole Al 3+. Dessinez le modèle planétaire
de l’ion aluminium.
Exercice 5
L’atome d’argent a pour symbole Ag et pour numéro
atomique Z=47.
1) Quelle
est la charge électrique portée par le noyau de l’atome
d’argent ?
2) L’ion
argent a pour formule chimique Ag+. Que signifie, par rapport
à l’atome, ce symbole Ag+ ?
3) Quelle
est la charge portée par le noyau de l’ion argent ?
Exercice 6
Le noyau de l’atome de zinc, de symbole Zn, porte, dans son
état normal, 30 charges positives. Un ion formé à partir de cet atome
présente 28 électrons.
1) Combien
d’électrons possède l’atome de zinc dans son état normal,
pourquoi ?
2) Combien
de charges positives trouve-t-on dans le noyau de l’ion zinc ?
Pourquoi ?
3) Écrivez
le symbole chimique de l’ion zinc.
Exercice 7
1) Le
glucose est un sucre de formule C6 H12 O6
. Donnez le nombre et le nom de chacun des atomes qui constitue cette
molécule.
2) Le
glucose est-il un corps pur ? simple ? composé ? un
mélange ? Justifiez.
3ème partie : exercices
Exercice 8
Quelle est la longueur correspondant à un million d'atomes de
cuivre de diamètre 0,26 nm, placés côte à côte (résultat à donner
en mètres) ?
Exercice 9
Une feuille d’aluminium a 0,0015 mm d’épaisseur. Chaque atome
est représenté par une sphère de 0,3 nm de diamètre.
Combien y a-t-il d'atomes d'aluminium dans cette épaisseur en supposant
qu'ils soient disposés les uns sur les autres ?
Exercice 10
Le rayon atomique de l’atome d’aluminium vaut 1,18 x 10-10
m, celui de l’atome de zinc vaut 125 x 10-12 m ; celui de
l’atome d'étain est de 14,1 x 10-8 mm.
1) Exprimez ces rayons atomiques en millimètre.
2) Classez ces trois atomes par taille croissante.
Exercice 11
Les masses des atomes d’aluminium, de cuivre et d'étain valent
respectivement 4,48 x 10-26 kg, 1,05 x 10-22 g et
19,71 x 10-20 mg.
1) Exprimez ces masses atomiques avec la même unité de masse (en
kg).
2) Classez ces masses par ordre croissant.
Exercice 12
1) La
masse d’un atome aluminium est 4,5 x 10-26 kg. Sachant que
dans cet atome il y a 13 électrons, chacun de masse 9,1 x 10-31
kg, calculez la masse du nuage électronique.
2) Comparez
la masse du nuage électronique à celle de l’atome.
Barème indicatif :
Exercices 1, 2, 3 à
4 points chaque
12 points
Exercices 4, 5, 6, 7 à
3 points chaque
12 points
Exercices 8, 9,10, 11 à
3 points chaque
12 points
Exercice 12 à
4 points
04 points
Total sur 40 ramenés à 20
CORRECTION
Exercice 1
Que savez-vous sur les atomes, leurs tailles, leur
composition ?
L'atome
est le plus petit constituant de la matière. Toute la matière, qu'elle
soit solide, liquide, gazeuse, est formée d'atomes. Les atomes sont très
petits. Il y a 105 atomes naturels, dont la taille est voisine de 10-10
mètres. Chaque atome est constitué d'un noyau constitué de protons
positifs séparés par des neutrons (neutres) ; autour du noyau gravitent,
en un nuage, les électrons négatifs.
Exercice 2
Que savez-vous sur les molécules ?
Une
molécule est constituée d'atomes. Les atomes s'associent dans une
molécule pour mettre des électrons en commun afin de saturer leurs
dernières couches électroniques.
Exemple : la molécule d'eau : H-O-H
Exercice 3
Que savez-vous sur les ions ?
Un
ion est atome ou un groupe d'atomes qui a gagné, ou qui a perdu, un ou
plusieurs électrons. Une perte d'électron(s), donc une perte de charge
négatives, donne naissance à un cation (ion positif), et un gain
d'électron(s), donc un gain de charges négatives, donne naissance à un
anion (ion négatif).
2ème partie : application directe du
cours
Exercice 4
Soit l’atome d’aluminium (Al ; Z=13).
1) Que
représente Z ?
2)
Quels sont les constituants de l’atome d'aluminium; quelles
sont leurs charges électriques ?
3) Dessinez
le modèle planétaire de l’atome d'aluminium
4) L’ion
aluminium a pour symbole Al 3+. Dessinez le modèle planétaire
de l’ion aluminium.
1)
Z représente le numéro atomique, c'est à dire le nombre de protons dans
le noyau.
2) L'atome d'aluminium possède un noyau avec 13 protons (positifs) et 13
électrons (négatifs) gravitent autour du noyau.
3)

4)
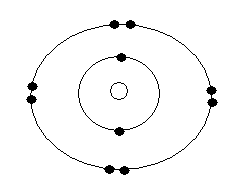
Exercice 5
L’atome d’argent a pour symbole Ag et pour numéro
atomique Z=47.
1) Quelle
est la charge électrique portée par le noyau de l’atome
d’argent ?
2) L’ion
argent a pour formule chimique Ag+. Que signifie, par rapport
à l’atome, ce symbole Ag+ ?
3) Quelle
est la charge portée par le noyau de l’ion argent ?
1)
Il y a 47 protons, donc 47 charges positives dans le noyau.
2) Il y a eu perte d'une charge négative, donc d'un électron.
3) Le nombre de protons dans le noyau n'a pas varié ; il y a toujours 47
charges positives.
Exercice 6
Le noyau de l’atome de zinc, de symbole Zn, porte, dans son
état normal, 30 charges positives. Un ion formé à partir de cet atome
présente 28 électrons.
1) Combien
d’électrons possède l’atome de zinc dans son état normal,
pourquoi ?
2) Combien
de charges positives trouve-t-on dans le noyau de l’ion zinc ?
Pourquoi ?
3) Écrivez
le symbole chimique de l’ion zinc.
1)
Dans son état normal un atome est électriquement neutre ; il y a autant
de charges négatives que de charges positives. Il y a donc 30 électrons
(30 charges négatives).
2) Un ion résulte d'un gain ou d'une perte d'électrons ; le nombre de
protons dans le noyau ne change pas. Il y a donc toujours 30 charges
positives.
3) Il y a eu perte de 2 électrons, donc de 2 charges négatives. L'ion
est donc Zn 2+
Exercice 7
1) Le
glucose est un sucre de formule C6 H12 O6
. Donnez le nombre et le nom de chacun des atomes qui constitue cette
molécule.
2) Le
glucose est-il un corps pur ? simple ? composé ? un
mélange ? Justifiez.
1)
La molécule se compose de 6 atomes de carbone, de 12 atomes d'hydrogène,
de 6 atomes d'oxygène.
2) Le glucose a une formule chimique, c'est un corps pur. Il est
constitué de 3 classes d'atomes, c'est un corps pur composé.
3ème partie : exercices
Exercice 8
Quelle est la longueur correspondant à un million d'atomes de
cuivre de diamètre 0,26 nm, placés côte à côte (résultat à donner
en mètres) ?
Longueur
totale = longueur d’1 atome x nombre d’atomes
L = 0,26 nm x 1 000 000 = 0,26 x 106 nm
= 0,26 x 106 x 10-9 m = 0,26 x 10-3 m
= 2,6 x 10-4 m = 0,26 mm
Exercice 9
Une feuille d’aluminium a 0,0015 mm d’épaisseur. Chaque atome
est représenté par une sphère de 0,3 nm de diamètre.
Combien y a-t-il d'atomes d'aluminium dans cette épaisseur en supposant
qu'ils soient disposés les uns sur les autres ?
épaisseur
= 0,0015 mm = 0,0015 x 10-3 m = 1,5 x 10-3 x 10-3
m = 1,5 x 10-6 m
diamètre
= 0,3 nm = 0,3 x 10-9 m = ( 3 x 10-10 m )
épaisseur
totale = épaisseur d’1 atome x nombre d’atomes
donc
nombre
d’atomes = épaisseur totale / épaisseur d’1 atome
N
= 1,5 x 10-6 m / 3 x 10-10 m = 0,5 x 104
atomes = 5 x 103 atomes (= 5 000 atomes)
Exercice 10
Le rayon atomique de l’atome d’aluminium vaut 1,18 x 10-10
m, celui de l’atome de zinc vaut 125 x 10-12 m ; celui de
l’atome d'étain est de 14,1 x 10-8 mm.
1) Exprimez ces rayons atomiques en millimètre.
2) Classez ces trois atomes par taille croissante.
1) Aluminium = 1,18 x 10-10 x 103 mm = 1,18 x
10-7
mm
Zinc = 12500 x 10-12cm = 1,25 x 104 x 10-12cm
= 1,25 x 104 x 10-12 x 10 mm = 1,25 x 10-7mm
Étain
= 14,1 x 10-8 mm = 1,41 x 10-7 mm
2)
aluminium < zinc < étain
Exercice 11
Les masses des atomes d’aluminium, de cuivre et d'étain valent
respectivement 4,48 x 10-26 kg, 1,05 x 10-22 g et
19,71 x 10-20 mg.
1) Exprimez ces masses atomiques avec la même unité de masse (en
kg).
2) Classez ces masses par ordre croissant.
1) Aluminium = 4,48 x 10-26 kg
Cuivre
= 1,05 x 10-22 g = 1,05 x 10-22 x 10-3 kg
= 1,05 x 10-25 kg = 10,5 x 10-26 kg
Étain = 19,71 x 10-20 mg = 19,71 x 10-20 x 10-6
kg = 19,71 x 10-26 kg
2)
Aluminium
< Cuivre < Étain
Exercice 12
1) La
masse d’un atome aluminium est 4,5 x 10-26 kg. Sachant que
dans cet atome il y a 13 électrons, chacun de masse 9,1 x 10-31
kg, calculez la masse du nuage électronique.
2) Comparez
la masse du nuage électronique à celle de l’atome.
1) La masse du nuage électronique est égale à :
m(nuage) = masse d'1 électron x nombre d'électrons
m(nuage) = 9,1 x 10-31 kg x 13 = 118,3 x 10-31 kg = 1,18 x 10-29
kg
2)
La
masse du nuage électronique est donc 1,18 x 10-29 kg / 4,5 x 10-26
kg = 1,18 x 10-29 / 4 500x 10-29
= 1,18 / 4 500 environ égale à 1 / 4 500
. La masse du nuage électronique est 4 500 fois plus petite que
la masse de l'atome. Toute la masse de l'atome est
concentrée dans le noyau.
|